活体动物体内光学成像主要采用生物发光与荧光两种技术。生物发光是用荧光素酶基因标记细胞或DNA,而荧光技术则采用荧光报告基团(GFP、RFP, Cy5及Cy7等)进行标记。
该技术最初是由美国斯坦福大学的科学家采用了世界上最优秀的高性能CCD研发与生产制造商最新研发的背部薄化、背照射冷CCD,配合密闭性非常好的暗箱,使得直接监控活体生物体内的细胞活动和基因行为成为现实。科学家借此可以观测活体动物体内肿瘤的生长及转移、感染性疾病发展过程、特定基因的表达等生物学过程。所以说该技术是伴随着背部薄化、背照射冷CCD的产生而产生,并随着该CCD技术的发展而发展。由于具有更高量子效率CCD的问世,使活体动物体内光学成像技术具有越来越高的灵敏度,对肿瘤微小转移灶的检测灵敏度极高。
在该技术诞生后的5、6年间,科学家借此取得了大量的科学成果,发表了几百篇文献资料,大部分都是应用以背部薄化、背照射冷CCD为核心部件的成像系统而得出的。活体动物光学成像技术的应用史,就是生物学家应用背部薄化、背照射冷CCD进行生物微弱发光检测的应用史。没有背部薄化、背照射冷CCD,就没有活体动物光学成像技术的诞生和发展。背部薄化、背照射冷CCD之所以促进活体动物光学成像技术的发展,主要是由于超低温的CCD芯片,CCD镜头温度越低,噪音越小,信噪比越好,灵敏度越高。正是由于背部薄化、背照射冷CCD对动物微弱发光的极高的灵敏度,才使得该项技术得到广泛的应用。由于卓越的背照射冷CCD技术的问世,科学家利用此技术进行了大量的研究,才使近年来产生了大量的高水平的应用活体成像技术进行肿瘤学、基因治疗、流行病学等研究的文献,极大的促进了生物医学在分子成像方面的发展。
诚实的讲,斯坦福的科学家在这方面进行了很多探索和尝试,他们在2000年-2001年仪器研发之初写过很多文献,探讨这些问题。是关于仪器的设计的。那时科学发展的必经之路。我觉得那些探索和尝试是有说服力的,是科学的态度和精神,抓住了问题的本质。在该技术诞生之初,科学家就对此进行的探索,见如下文献:In vivo imaging of light-emitting probes Journal of Biomedical Optics 6(4), 432–440 October 2001 文中详细描述了活体动物光学成像技术对CCD的特殊要求,见下面的文字:

文中详细描述了应用在活体成像实验中的CCD的性能要求:背部薄化、背照射冷CCD。并指出了背部薄化、背照射冷CCD是用于活体成像技术的最合适的CCD的选择。活体生物发光成像技术随着背部薄化、背照射冷CCD技术的产生而产生,并随着该CCD技术的发展而发展。背照射、背部薄化冷CCD是经过探索得出的结论,灵敏度是最本质的需要,有过很多比较和尝试,最后才形成共识。
之所以叫冷CCD,是由于CCD的芯片温度下降到零下20℃或110℃,可以降低噪音,提高检测的灵敏度。JPLY的制冷技术可以使CCD的温度达到-20℃,那样的温度可以使背照射冷CCD的暗电流减少到可忽略不计的水平。该CCD的2erms的电子噪音代表了最小的噪音底线,信号强度肯定会大于那样的噪音水平,使该CCD具有很高的信噪比,检测的特异性很强。
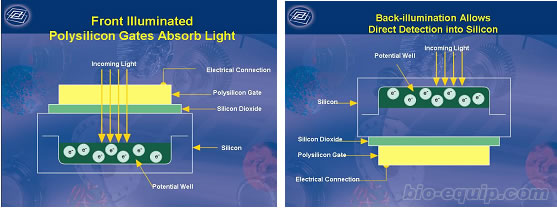
关于CCD的前照射与背照射的问题。前照射CCD,在光信号到达CCD芯片之间的光路上有多硅层和二氧化硅层,那将减少CCD的量子效率,造成光信号的衰减,降低灵敏度。背照射、背部薄化CCD则是在光信号到达CCD芯片之间的光路上去掉了多硅层和二氧化硅层,那大大提高了检测的效率,但是同时极大的增加了生产的成本。所以活体光学成像系统才有那令人费解的高昂的价格。但对于较强的荧光信号来说,不需要很灵敏的CCD就可以检测到,多硅层和二氧化硅层还可以起到保护芯片的作用。所以一般单纯检测荧光,一般用前照射的CCD,检测生物发光和荧光,则建议用背照射的CCD。在体外实验中,一般都是用前照射的CCD,可以说在生物学的大部分实验中所使用的都是前照射的CCD,背照射的CCD,只有在检测非常微弱的生发光信号时才有用武之地。下图是前照射CCD与背照射的CCD原理结构图。
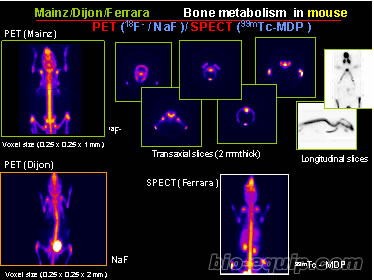 不适合。由于荧光标记检测的灵敏度,以及荧光检测的深度等限制,活体光学成像不是很适合进行小分析药物活体示踪的实验。核素标记的PET和SPECT技术由于检测的深度、灵敏度以及标记的原因是适合进行小分析药物活体示踪实验的技术,该领域是一个正在蓬勃发展的领域,但是由于GE、西门子等公司的相关产品价格昂贵,很难满足大多数科研工作者的需要,所以一时间该技术没有得到普及和应用。但是国外有一些公司正在开发价格适中的产品,不久就会进入中国市场,将使中国的科研工作者应用该技术进行小分子药物的吸收、分布、代谢、分泌等研究变的方便起来。该技术可以实现三维成像,详细了解标记物的位置。应用该技术进行骨骼代谢的例子见右图:
不适合。由于荧光标记检测的灵敏度,以及荧光检测的深度等限制,活体光学成像不是很适合进行小分析药物活体示踪的实验。核素标记的PET和SPECT技术由于检测的深度、灵敏度以及标记的原因是适合进行小分析药物活体示踪实验的技术,该领域是一个正在蓬勃发展的领域,但是由于GE、西门子等公司的相关产品价格昂贵,很难满足大多数科研工作者的需要,所以一时间该技术没有得到普及和应用。但是国外有一些公司正在开发价格适中的产品,不久就会进入中国市场,将使中国的科研工作者应用该技术进行小分子药物的吸收、分布、代谢、分泌等研究变的方便起来。该技术可以实现三维成像,详细了解标记物的位置。应用该技术进行骨骼代谢的例子见右图:
精谱徕拥有一群经验丰富的技术人员,若您有难以解决的成像问题,请致电 020-38077661